丁建平研究组等合作揭示线粒体膜间隙磷脂酸转运的分子机制
来源:
时间:2015-08-07
2015年6月13日,国际权威期刊 EMBO Reports在线发表了中科院上海生科院生化与细胞所/国家蛋白质科学中心·上海丁建平研究组和植生生态所张鹏、薛红卫研究组的一项合作研究成果。该工作报道了线粒体膜间隙磷脂转运蛋白Ups1-Mdm35复合体的结构,基于结构分析和一系列体内和体外功能分析结果,揭示了Ups1-Mdm35复合体在线粒体膜间隙中结合并转运磷脂酸(PA)的分子机制。
心磷脂(CL)是线粒体内膜的特征性磷脂,它的合成与代谢直接影响到线粒体功能的正常发挥,进而影响整个细胞的功能。心磷脂的合成前体是PA,PA在内质网中合成后被运输到线粒体外膜,进而由线粒体膜间隙蛋白复合体Ups1-Mdm35从外膜转运到内膜供给CL的合成,这一转运过程受到线粒体内膜CL量的反馈调控。该过程广泛存在于生物体中。然而,目前人们对Ups1-Mdm35介导的线粒体膜间隙PA转运及反馈调控过程的分子机制不清楚。
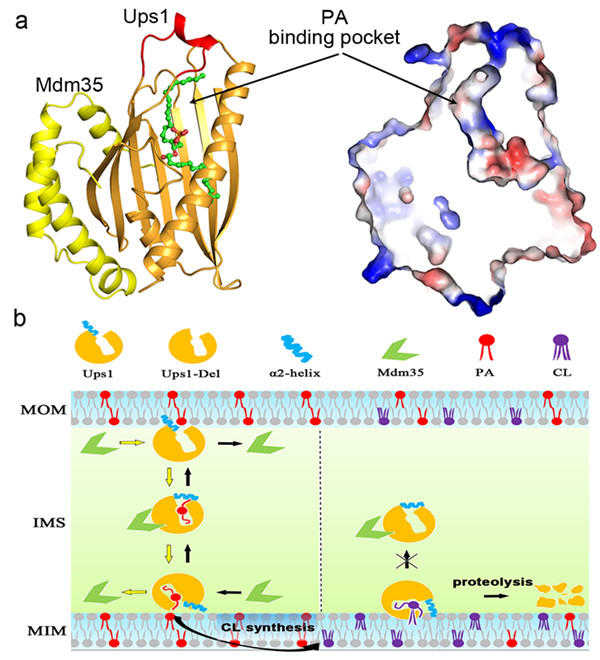
该研究团队通过体外表达获得了具有生物活性的Ups1-Mdm35蛋白复合体,解析了Ups1-Mdm35和Ups1-Mdm35-PA两种复合体的晶体结构。结构分析揭示了Ups1是由一个反向平行的折叠和三个螺旋组成的筒状结构,Mdm35则是由三个螺旋组成一个发夹结构(图a)。Mdm35从侧面围绕Ups1从而形成一个稳定的功能复合体。Ups1的折叠和螺旋形成一个容纳PA分子的口袋,口袋上方的螺旋形成一个盖子结构。通过体内和体外的生理和生化数据显示,口袋中与PA分子脂肪链结合的疏水性氨基酸以及螺旋对PA的结合与转运起着关键的作用。Mdm35与 Ups1结合区域的氨基酸对复合体的稳定与PA的正常转运起到重要作用。结构分析还发现了一个位于Ups1表面的带正电荷的亲水区域,研究提示该区域有助于复合体结合到膜上获取PA。
研究人员基于Ups1-Mdm35-PA复合物结构和功能分析,构建了Ups1-Mdm35与CL结合的模型,完善了Ups1-Mdm35转运PA的工作模型(图b):Ups1依靠其分子表面带正电荷的亲水区域通过电荷相互作用靠近线粒体外膜,Ups1上的螺旋产生构象变化,打开底物结合口袋,从而获取外膜上的PA分子。一旦PA分子进入底物结合口袋,螺旋关闭,随即Mdm35与Ups1-PA结合形成Ups1-Mdm35-PA三元复合物并从外膜上解离下来。Ups1-Mdm35携带PA分子穿过线粒体膜间隙到达内膜上,螺旋构象改变打开底物结合口袋,释放PA分子供给CL的合成,从而完成PA从外膜到内膜的转运。这一过程是动态变化并且可逆的,PA的转运动力依赖于内外膜上PA的浓度差。当内膜上CL合成足量时, CL会利用四条脂肪连中的两条结合Ups1-Mdm35,另两条链插入内膜从而将Ups1-Mdm35捕获在内膜上(进而被蛋白酶降解),从而反馈调控Ups1-Mdm35对PA的转运。
丁建平研究组的助理研究员俞芳和张鹏研究组的博士研究生何方圆为该项工作的共同第一作者。感谢上海光源和国家蛋白质科学研究(上海)设施17U/19U线站在实验数据收集中的支持与帮助。研究得到了基金委和中科院项目的支持。